
Perteneciente al área temática Estructura atómica, este ítem se refiere a las capas o niveles de
Erwin Schrödinger propuso el modelo mecánico cuántico del átomo, el cual trata a los electrones como ondas de materia. , representa la probabilidad de encontrar un electrón en una región dada dentro del átomo. Un orbital atómico está definido como la región dentro de un átomo que encierra donde posiblemente esté el electrón el 90%.
BIENVENIDS AL MARAVILLOSO MUNDO DE LA BIOLOGÍA 720 NIVELES DE ENERGIA
Los niveles de energía rotacional dependen únicamente del momento de inercia I y del número cuántico del momento angular orbital l (en este caso, l = 0 l = 0, 1, y 2). El momento de inercia depende, a su vez, de la distancia de separación en equilibrio (que está dada) y de la masa reducida, que depende de las masas de los átomos de H y Cl.

Niveles Energéticos Orbital atómico Configuración electronica
Sin encabezados. A partir del Capítulo 20, volvemos nuestra atención hacia la distribución de energía entre las moléculas en un sistema cerrado que se sumerge en un baño de temperatura constante, que está en equilibrio, y que contiene un gran número de moléculas.Queremos encontrar la probabilidad de que la energía de una molécula en dicho sistema se encuentre en un intervalo.

[Resuelta] theoreticalchemistry Colocación energética de
Mapa: Química - La naturaleza molecular de la materia y el cambio (Silberberg) 7: Teoría cuántica y estructura atómica. principal n corresponde a la n utilizada por Bohr para describir órbitas de electrones y por Rydberg para describir los niveles de energía atómica.. El modelo cuánto-mecánico del átomo is shared under a not.

Introduzir 37+ imagem ao que correspondem os níveis energéticos no modelo de rutherfordbohr
Esto se llama la longitud de onda de De Broglie.A diferencia de los otros valores de λ que se analizan en este capítulo, la longitud de onda de De Broglie es una característica de las partículas y otros cuerpos, no de la radiación electromagnética (nótese que esta ecuación involucra la velocidad [v, m/s], no la frecuencia [ν, Hz].Aunque estos dos símbolos parecen casi idénticos.

CUALES SON LOS NIVELES DE ENERGÍA DEL ÁTOMO _ Representación en Números y letras YouTube
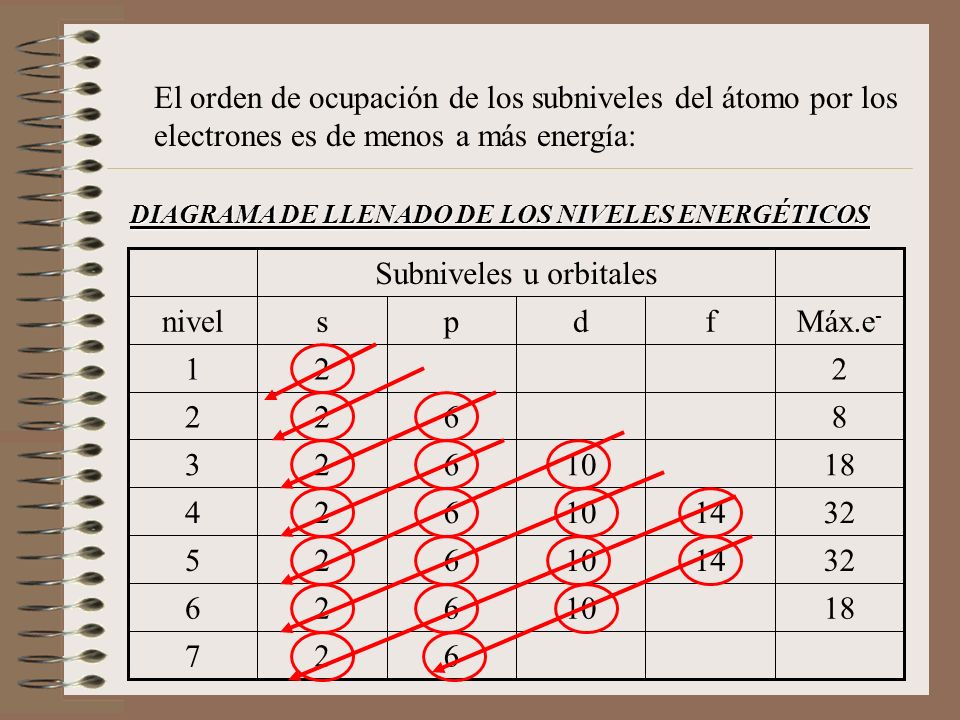
Podemos resumir las relaciones entre los números cuánticos y el número de subcapas y orbitales como sigue (Tabla 6.5.1) Cada capa principal tiene n subcapas. Para n = 1, una sola subcapa es posible (1 s ); para n = 2, hay dos subcapas (2 s y 2 p ); para n = 3, hay tres subcapas (3 s, 3 p, y 3d ); y así siguiendo.

Modelos Atomicos Y Distribucion De Electrones Por Niveles De Energia Otosection
Gases y teoría cinética molecular. Unidad 11. Estados de la materia y fuerzas intermoleculares. Unidad 12.. Niveles energéticos del modelo de Bohr (obtención con el uso de física). Aprende. El modelo mecánico cuántico del átomo (Abre un modal) Principio de incertidumbre de Heisenberg (Abre un modal) Números cuánticos (Abre un.
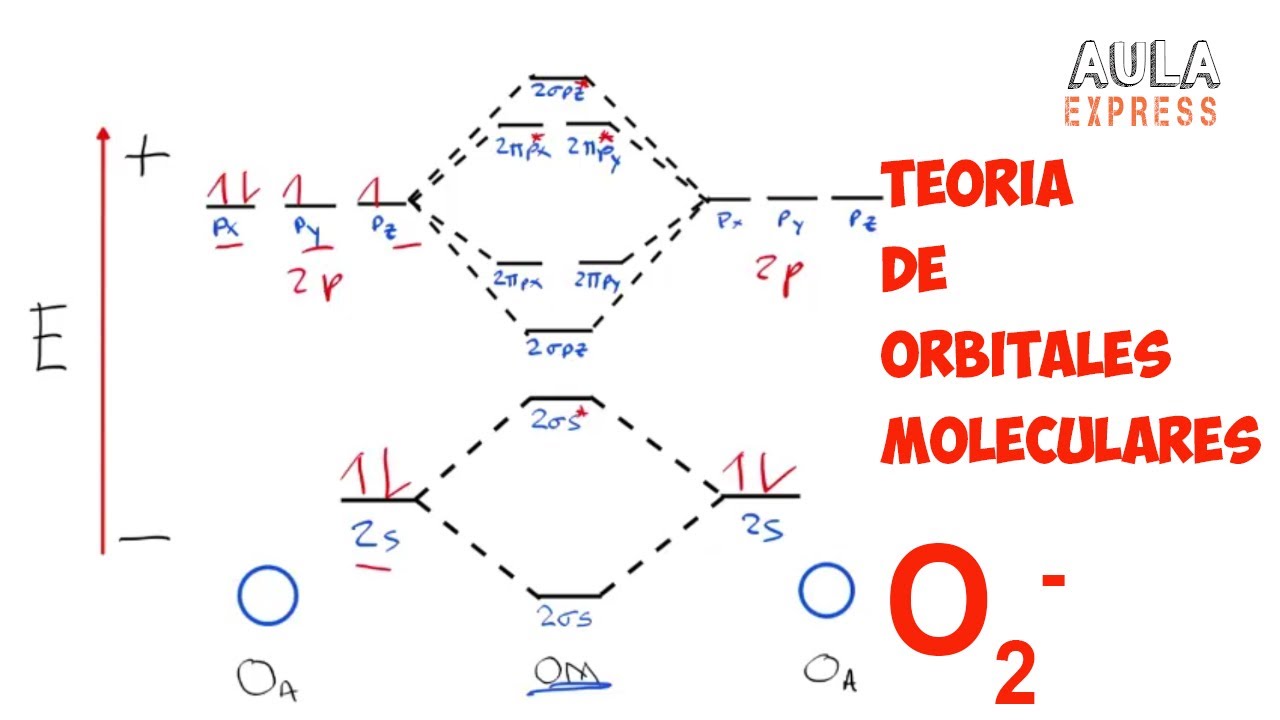
QUIMICA TEORIA DE ORBITALES MOLECULARES ion superóxido (O2) Ejercicio Resuelto AULAEXPRESS
Aprende sobre los conceptos básicos de la estructura atómica con este video educativo de Khan Academy en Español. Descubre cómo se organizan los electrones en orbitales, capas y niveles.

En Los Niveles De Energía Existen Subniveles De Energía Electronica
18.6: Funciones de onda, estados cuánticos, niveles de energía y degeneraciones. Aproximamos la función de onda para una molécula usando un producto de funciones de onda aproximadas, cada una de las cuales modela algún subconjunto de los movimientos que experimenta la molécula. En general, las funciones de onda que satisfacen la ecuación.

Electrones en niveles de energía
Niveles energéticos del modelo de Bohr. Google Classroom. Acerca de. Transcripción. Calculamos la energía del electrón de los niveles n=1 hasta 3. Dibujamos un modelo de capas y un diagrama de energía para el hidrógeno, y luego usamos los diagramas para calcular la energía requerida para excitar un electrón de un nivel de energía a otro.

Niveles Energeticos Quimica Acido
Digamos que, en nuestro átomo inventado, los electrones tienen niveles de energía en cero eV, cuatro eV, seis eV y siete eV. Ten en cuenta que moverse a la izquierda o a la derecha en un diagrama de niveles de energía no representa nada significativo, así que técnicamente no hay un eje x en este diagrama, pero lo dibujamos de todas formas.

Como es el átomo según el modelo mecanocuantico? Y como se distribuyen los electrones en el
Tema 2: Estructura de la Materia. 2.01 Radiación electromagnética y espectros atómicos. 2.02 Orígenes de la Teoría cuántica. 2.03 Modelo de Bohr para el átomo de hidrógeno. 2.05 Modelo cuántico para el átomo de Hidrógeno. 2.06 Números cuánticos y orbitales. Energía de los orbitales atómicos.
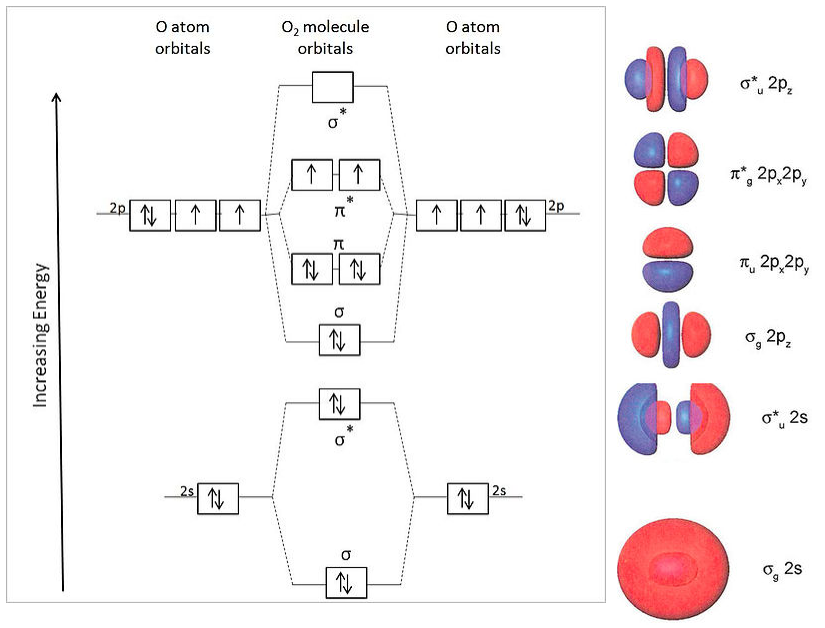
2.6 Llenado orbital LibreTexts Español
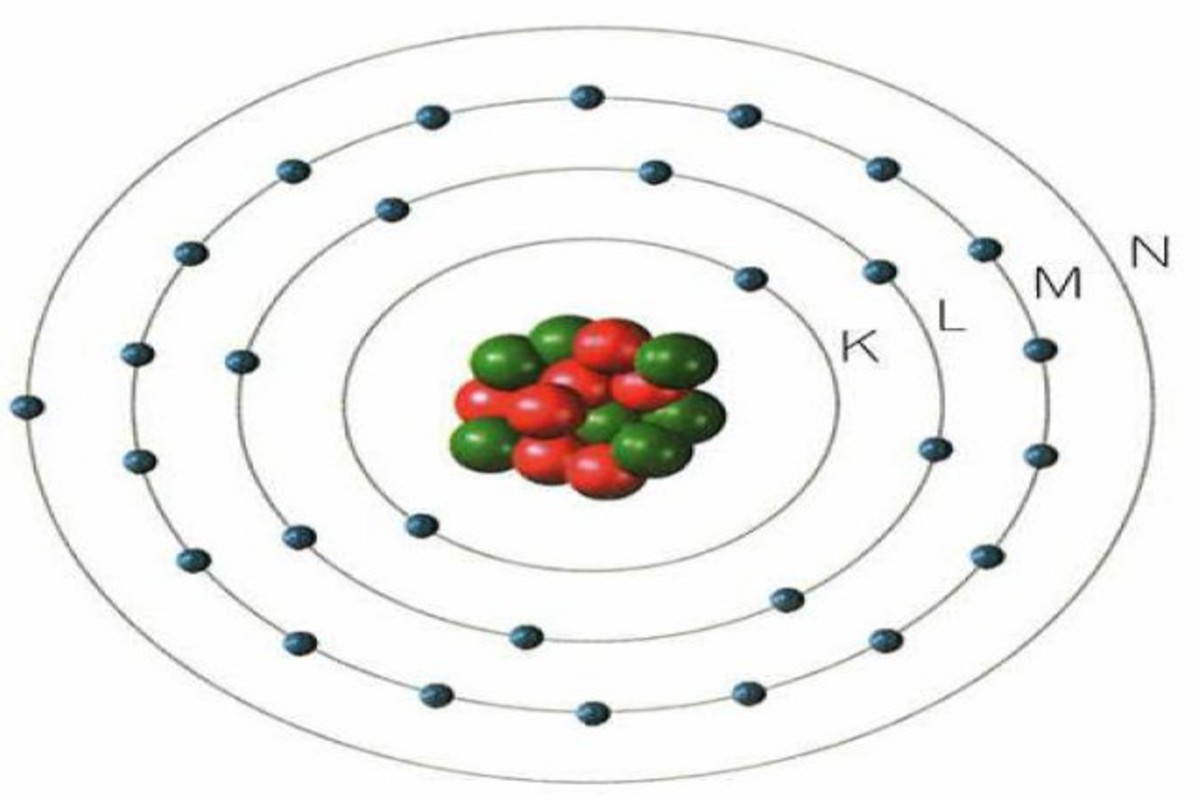
Los orbitales electrónicos son regiones espaciales, ubicadas en los distintos niveles energéticos definidos por Bohr, en torno a un núcleo atómico donde los electrones se disponen.. Representación del átomo de carbono de acuerdo al modelo de Bohr y al modelo mecanocuántico, indicando en este último la disposición de los electrones.
Modelo De Atomo De Bohr La Fisica Y Quimica Images
This page titled 5.11: Modelo atómico mecánico cuántico is shared under a CK-12 license and was authored, remixed, and/or curated by CK-12 Foundation via source content that was edited to the style and standards of the LibreTexts platform; a detailed edit history is available upon request. El modelo mecánico cuántico del átomo proviene de.
Arriba 57+ imagen modelo atómico de bohr niveles de energía Thcshoanghoathambadinh.edu.vn
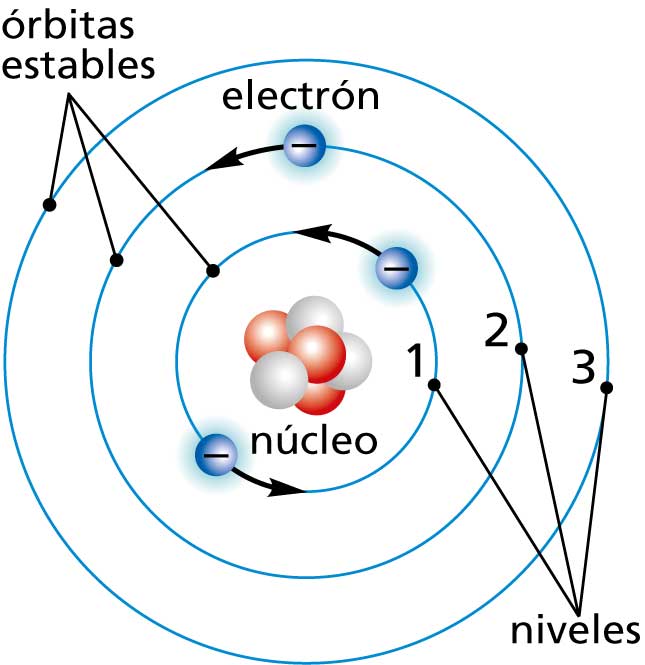
Nivel energético. Esquema de los niveles energéticos de un átomo hidrogenoide. En mecánica cuántica, un nivel energético es un estado (o conjunto de estados) cuya energía es uno de los valores posibles del operador hamiltoniano, y por lo tanto su valor de energía es un valor propio de dicho operador. Matemáticamente los estados de un.

Modelo atómico de Bohr ️ ¿Qué es? ️ ¿En que consiste?
El cuarto nivel y los niveles superiores, además de todos los anteriores, también tienen un subnivel f que contiene siete orbitales f, y que pueden contener un máximo de 14 electrones. Así, el cuarto nivel puede contener hasta 32 electrones: 2 en el orbital s, 6 en los tres orbitales p, 10 en los cinco orbitales d y 14 en los siete orbitales f.







